User:Wingless reindeer/物理有機化学
This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages)
|
物理有機化学とはルイス・ハメットが1940年に造語した有機化学の一分野であり、化学構造と反応性の関係に焦点を当てている。特に物理化学の実験的手法を有機分子の研究に応用するものである。具体的な注目内容として、有機反応の反応速度論、出発物質の相対的な化学的安定性、反応中間体、遷移状態、 化学反応の生成物、化学的反応に影響を与える溶媒和および分子間相互作用の非共有結合的な様相などが挙げられる。このような研究でもたらされた理論的・実験的フレームワークにより、各有機反応において溶液中または固体状態での構造変化が反応機構や反応速度に与える影響の理解につながる。
応用分野[edit]
物理有機化学者は古典的・統計的熱力学の計算、量子力学理論と計算化学、実験的分光法(例:NMR)、スペクトロメトリー(例:MS)、結晶学などの理論的・実験的アプローチを利用して、有機化学の根本的な問題の理解に取り組む。そのため物理有機化学は電気化学と光化学、高分子と超分子化学、および生物有機化学、酵素学、ケミカルバイオロジー、さらにはプロセス化学、化学工学、材料工学およびナノテクノロジー、創薬の設計など、詳細に特化した分野で幅広く応用されている。
領域[edit]
物理有機化学は、有機化合物の分子構造と反応性との関係を研究する学問分野である。より具体的には、有機分子の構造の研究に物理化学の実験手法を適用することで、分子構造が有機化学の反応機構と反応速度にどのように影響するかを解釈する理論的枠組みとする。物理有機化学は有機化学と物理化学をつなぐ区分下領域と考えられる。
物理有機化学の分野では、分光法、スペクトろメトリー、結晶学、計算化学、量子論などの実験的・理論的な手法を使用して、有機反応の反応速度や出発物質、遷移状態、生成物の相対的な化学的安定性を研究する。[1][page needed] 本分野の化学者は現代の有機化学の物理的な基盤の理解に努めており、それゆえ物理有機化学は高分子化学、超分子化学、電気化学、光化学などの特殊な分野で応用される。[1][page needed]
歴史[edit]
「物理有機化学」という用語自体は1940年にルイス・ハメットが自著の教科書のタイトルとして初めてこのフレーズを使用した。[2]
化学構造と熱力学[edit]
熱化学[edit]
有機化学者は熱力学を駆使して化学系の結合、安定性、エネルギー論を研究する。これには反応、変性、または異性化のエンタルピー(ΔH)、エントロピー(ΔS)、およびギブズの自由エネルギー(ΔG)を測定・決定するための実験などがある。ファントホッフの式などさまざまな化学的・数学的解析を使用して、これらの値が計算される。
実験定数である結合解離エネルギー、標準生成熱 (ΔHf°)、燃焼熱 (ΔHc°) などの定数により、分子の安定性と反応過程でのエンタルピー変化(ΔH)が予測できる。複雑な分子の場合、全体のΔHf°の値が分からなくとも、既知の生成熱が判明している分子フラグメントからそのΔHf°値を推定できる。こうした解析手法は、化学者シドニー・ベンソンが概念を開発したことからしばしば「ベンソン・グループ増分理論」と呼ばれる。[1][page needed][page needed] [3][4]
反応中間体であるカルボカチオン、カルバニオン、ラジカルの熱化学も、物理有機化学者の研究対象となる。ラジカル系については群増分データを利用することができる。[1][page needed][page needed] カルボカチオンとカルバニオンの安定性は、それぞれハイドリドイオンの親和性とpKa 値で求められる。[1][page needed]
立体配座解析[edit]
化学的安定性とエネルギーを求める主な手法の一つが立体配座解析である。物理有機化学では立体配座解析を使用し、分子内に存在するさまざまな種類のひずみを計算することで反応生成物を予測する。[5][page needed] ひずみは非環状分子と環状分子の両方に見られ、ねじれのひずみ、アリルひずみ、環ひずみ、syn-ペンタン相互作用として現れる。[1][page needed] A値とは、置換シクロヘキサンの立体配座を予測するための定量的な基準となる値である。置換シクロヘキサンは、配座によって活性度が強く誘導される、環状有機化合物の中でも重要なものである。A値とは、eq-置換シクロヘキサンとax-置換シクロヘキサン間の平衡のギブス自由エネルギーの差であり、さまざまな置換基のA値を合計することでシクロヘキサン誘導体の望ましい構造を定量的に予測できる。
立体配座解析は分子の安定性だけでなく、反応生成物の予測にも使用される。例えば二分子脱離反応(E2反応)である。この反応は、求核物質が離脱基に対してねじれの向きに攻撃する場合に最も容易に進行する。その現象の分子軌道解析によれば、求核攻撃される R-H σ 結合軌道の電子と、切断された R-X 結合の空の σ* 反結合性軌道とがこの立体配座により最もよく重なるからであると考えられている。[6][page needed]この効果を利用することで、立体配座解析はより高い反応性を持つ分子を設計できる。
結合回転障壁に至る物理的プロセスは複雑であり、これらの障壁は実験的・理論的な手法により広範に研究されている。[7][8][9]最近、多数の論文でエタン、ブタン、そしてさらに置換された分子における立体障害的、静電的、および超共役的な寄与が回転障壁を上回ると研究報告されている。 [10]
非共有相互作用[edit]
[[ファイル:Cryptand_complex.svg|left|thumb|200x200px|金属カチオンとホスト–ゲスト反応を示すクリプタンド。クリプタンドは、静電相互作用(イオン–双極子相互作用)によってゲストカチオンをしっかりと取り囲む三環化合物である。]] 化学界では分子内や分子間の非共有結合・相互作用を研究して反応性を評価する。このような相互作用には、水素結合、帯電分子間の静電相互作用、双極子–双極子相互作用、極性–π相互作用およびカチオン–π相互作用、π-スタッキング、ドナー–アクセプター反応、ハロゲン結合などがある。さらに水中での有機化合物の会合、すなわち疎水効果も静電的な非共有結合として化学の研究対象である。疎水効果の起源となる詳細な物理的作用は多くの複雑な相互作用から生じているが、水中での生体分子の認識において最も重要な要素であると考えられている。[1][page needed] 例えばXuとMelcherらは、葉酸受容体タンパク質による葉酸の認識の構造的な基本原理を解明した。[11] 葉酸と葉酸受容体との強力な相互作用は水素結合と疎水性相互作用の両方に帰因した。非共有結合の研究は超分子の会合や、クラウンエーテル、クリプタンドなどのゲスト分子に対するホストとして機能する大員環化合物の結合と共同性の研究にも利用される。
酸-塩基化学[edit]
[[ファイル:PKa_phenol_vs_nitrophenol.svg|right|thumb|300x300px|フェノール(A)とp-ニトロフェノール(B)の酸解離定数(pKa)値が大きく異なる理由について、誘起効果および共鳴理論の原理で説明される。Bでは電気陰性のニトロ基が誘起効果、および負電荷の非局在性による共役塩基(フェノキシドアニオン)との共鳴により安定化する。]] 酸と塩基の性質は物理有機化学に関連する。有機化学では主に電子供与体/受容体であるブレンステッド-ローリーの酸/塩基、そして有機反応において電子受容体/供与体であるルイス酸/塩基を研究対象とする。相対的な酸性度と塩基度を予測するためには、物理化学から導かれた一連の因子である、電気陰性度/誘起効果、結合強度、共鳴、混成軌道、芳香性、溶解度が用いられる。
分子間相互作用および反応の方向の予測にはHSAB則が用いられる。一般的に、同じタイプの分子同士の相互作用が大きくなる傾向にある。すなわち、硬い酸は硬い塩基と結合し、軟らかい酸は軟らかい塩基と結合する。硬い酸と塩基の概念は、無機錯体の合成に用いられることが多い。
反応速度論[edit]
化学反応速度と反応機構の研究には反応速度論の数学的基本原理を用いる。反応速度と平衡濃度(ΔG°)の相対的な安定性を扱う熱力学とは異なり、反応速度論の研究は反応の開始構造と遷移状態構造との間の活性化エネルギーの差(ΔG‡)に焦点を当てる。これにより化学平衡過程の研究が可能となる。[1][page needed] ハモンドの仮説、カーティン・ハメットの原理、および微視的可逆性の理論など数学的に導かれた形式論が有機化学に用いられることが多い。また、反応生成物に影響を与えるために熱力学対動力学制御の原理が用いられる。
反応速度式[edit]
反応速度論の研究を用いて反応速度式が決定される。反応速度式は、化学反応の速度と存在する化学種の濃度または圧力との間の定量的な関係を示す。[12][page needed] 反応速度式は実験測定によって決定され、通常は化学反応式だけでは分からない。実験的に決定された反応速度式は、基底状態構造に対する遷移状態構造の化学量論に関係する。歴史的には反応速度式の決定は、反応中の反応物濃度を重量分析によりモニタリングすることで行われていたが、現在ではほとんどが迅速で明確な分光法によって行われる。多くの場合、反応物のうちの一つを大量に添加することによって(大量投与)速度方程式の決定を簡易なものにする。
触媒[edit]
[[ファイル:Catalytic_reaction_coordinate.jpg|right|thumb|350x350px|この反応座標エネルギー図は非触媒反応と触媒反応を示しており、触媒反応については反応機構の変化の有無について示す。[citation needed] 曲線A(橙色)は非触媒反応経路とその活性化エネルギーを示す。曲線B(青)は触媒反応経路であり、相対的に活性化エネルギーが小さいことを示す。曲線C(茶色)は、同じ反応が異なる反応機構により進行した、複雑な別の反応経路を示す。これには速度論的に分離した2つの反応性中間体を含む。]] 触媒と触媒反応の研究は、物理有機化学の分野で非常に重要なものである。触媒は化学反応に加わっているが、反応過程では消費されない。[12][page needed] 触媒は反応速度を増加させることができるが、これは遷移状態の構造を安定化させるか、あるいは重要な反応中間体を不安定にさせることによって活性化エネルギー障壁(ΔG‡)を下げるからである。たとえわずかな量であっても触媒を加えることにより、通常は合成に費用がかかる、あるいは合成が難しい有機分子を経済的に得ることができる。また、触媒は反応機構を変えることによっても反応速度に影響を与えることがある。[1][page needed]
同位体の速度論的な影響[edit]
速度定数式からは遷移状態構造である分子の化学量の情報は得られるが、結合の切断や形成に関する情報はない。.[13][page needed] 反応性の高い位置の近くである原子をその同位体に置換すると、反応速度が変化することが多い。同位体の置換は反応中間体や遷移状態のポテンシャルエネルギーを変化させるが、これは同位体が重いほど他の原子とより強い結合を形成するためである。原子の質量は関連する分子のゼロポイント振動準位に影響を与え、より重い同位体を含む分子では短く強い結合が形成され、より軽い同位体を含む分子では長く弱い結合が形成される。[14][page needed] 反応過程では、結合が形成されたり切断されたりすることにより、振動の動きが変化することがあるため、振動数にも影響が及ぶ。これを観測することで、同位体置換により反応機構と速度定数に関する見識が得られる。
置換基の影響[edit]
置換基が分子の反応性や反応速度に与える影響は、化学界の大きな研究対象である。置換基は立体障害および電子的相互作用を介して影響を及ぼすことがあり、後者には共鳴や誘起効果などがある。分子の分極率も影響を受ける可能性がある。多くの置換基の影響は線形自由エネルギー関係(LFER)により分析される。その中で最も一般的なものはハメット則プロット分析である。[15][page needed] この分析では、さまざまな置換基が安息香酸のイオン化に及ぼす影響を、さまざまな化学系において比較するものである。ハメット則プロットのパラメータにはシグマ(σ)とロー(ρ)がある。σの値は、無置換の安息香酸に対する置換安息香酸の酸性度を示す。正のσ値は置換安息香酸の酸性度がより強いことを示し、負の値は置換安息香酸の酸性度がより弱いことを示す。ρ値は置換基の変化に対する反応性の高さを示す尺度であるが、誘起効果のみの尺度である。したがって、共鳴による局所的な電荷の安定化を評価するためにσ+とσ−という2つの新しい尺度が生まれた。σ+は共鳴を介して正の電荷を安定化させる置換基に関連し、σ−は共鳴を介して負の電荷を安定化させる置換基に関連する。ハメット則分析は、起きうる反応機構の解明に役立つことがある。たとえば、遷移状態の分子構造が基底状態の構造に比べて負の電荷が蓄積すると予測される場合、電子供与基が反応速度を増加させていると推測される。 [15][page needed][16]
他のLFER尺度も研究が進んでいる。立体障害や極性の効果はタフトパラメータにより分析される。反応物ではなく溶媒を変更することで、反応中の電荷の変化に対する見識が得られる。グルンワルド-ウィンシュタインプロットを行うと、これらの効果に対する量的な見解が得られる。[17][page needed]
溶媒の効果[edit]
溶媒は溶解度、安定性、反応速度に大きく影響することがある。溶媒を変更することで、化学反応の熱力学的制御と速度論的制御に影響を与えられる可能性がある。化学物質の転換中に電荷分布が変化するため、異なる溶媒中では反応が異なる速度で進行する可能性がある。溶媒効果は基底状態・遷移状態の分子構造に作用することがある。[18][page needed]
有機反応における溶媒効果の一例は、 SN1 反応と SN2 反応の比較で見られる。[19][further explanation needed]
溶媒は系の熱力学的平衡にも大きく影響する可能性がある。たとえば、ケト-エノール平衡状態などである。非プロトン性の非極性溶媒では、分子内水素結合の形成によりエノールの割合が大きく増加する。一方、ジクロロメタンなどの極性非プロトン性溶媒では、極性溶媒と極性ジケトンとの相互作用のためエノールの形態が減少する。[example needed] プロトン性溶媒では、分子内水素結合が溶媒由来の水素結合と競合するため、平衡はケトの形態に傾く。[20][non-primary source needed] [21][non-primary source needed][22][non-primary source needed]
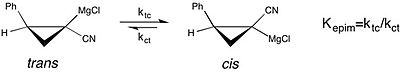
化学平衡の溶媒効果研究における現代の例として、キラルのシクロプロピルニトリルグリニャール試薬のエピメリ化研究が挙げられる。[24][non-primary source needed] この研究によればグリニャール試薬のシス–トランス異性化の平衡定数は、THFが反応溶媒であるとき非常に大きく(cis型に平衡が傾き)、ジエチルエーテルが溶媒のときよりも優位である。しかし、THF中でのシス–トランス異性化の速度が速いため、立体化学的な純度を保つことはできない。このケースでは、不斉合成で観測される選択性に関し、反応溶媒が試薬の立体配置の安定性に与える影響を理解することが重要である。
量子化学[edit]
有機化学において化学構造と反応性の関係性の多くは、共鳴、電子の押し出し、誘起効果、オクテット則、s-p混成軌道を通じて理論的に説明が付くが、これらは単なる有用な定式であり、物理的な現実を表しているわけではない。これらの制約から、物理有機化学を真に理解するには素粒子物理学に基づいたより厳密なアプローチが必要となる。量子化学は厳密な理論的なフレームワークであり、電子構造の計算により分子特性の予測能力があるため、ソフトウェアパッケージとして普及しており物理有機化学の研究に広く利用されている。[citation needed]量子化学は原子の波動モデルに基づく。このモデルでは、原子核は非常に小さく、正に帯電した球であり、その周りを広がった電子雲が取り囲んでいる。粒子は関連する波動関数、すなわちその粒子に関連するすべての情報を含む方程式によって規定される。[12][page needed] この情報は、数学演算子の使用によって波動関数から抽出される。
ある特定の波動関数に関するエネルギーは、シュレーディンガー方程式(上記、Ψは波動関数、Eはエネルギー、Ĥはハミルトニアン演算子)[12][page needed] を適切なハミルトニアン演算子で解いて得られる。多くの形態のシュレディンガー方程式では、粒子の質量が小さいほど、粒子の確率分布の全体的なサイズが広がっている。このため量子化学を実際に適応する場合、軽い電子に比べて核は無視できるほど小さいため点電荷として扱われる。
電子同士の反発により複雑な相互作用が生じるため、シュレーディンガー方程式を代数的に解くことができるのは水素原子、H2+、H32+ などのような1電子系のみである。しかし、これらの単純なモデルから、よく知られた原子軌道(s、p、d、f)と結合軌道(σ,π)がすべて算出できる。多電子系ではすべての情報を包括した、全体で一つの多電子波動関数が生成される。このような波動関数は、単一の電子の波動関数を線形で足し合わせて波動関数を推定するところから開始し、続いて関連するエネルギーが最小になるまで何度も修正を繰り返す。良好な解が見つかるまでには何千もの推測が必要になることも多く、これらの計算は高性能なコンピュータによって実行される。重要なことは、複数の電子を持つ原子の波動関数の解により、原子の直径や電気陰性度など実験データと周期表のパターンを忠実に映し出す特性が得られることである。分子に対する解については、実験的な手法では得られなかったメタンのような分子の電子構造の正確な図示が得られる。[citation needed] 例えば、炭素から各水素原子へ4つの離散したσ-結合が延びているのではなく、理論では4つの結合分子軌道が分子全体に拡散していると予測される。同様に、1,3-ブタジエンの真の電子構造は、単純なルイス構造式で推測される2つの孤立した二重結合ではなく、分子全体に広がったπ-結合の分子軌道が示される。[citation needed]
電子構造が完全であるとき、特に芳香族分子、拡張π結合系、金属イオンと有機分子の間の結合、有機セレン化合物や有機ホウ素化合物のような標準的でないヘテロ原子を含む分子、およびタンパク質などの大きな分子の立体配座の反応性などを精度よく推定できる。タンパク質については化学的な形式で近似が多数行われているが、分子構造や反応性の推定は不可能である。電子構造の決定は物理有機化学の研究上有益なツールであり、例としてベンゼンの金属触媒による脱芳香化が挙げられる。クロムトリカルボニルは、電子が占有していたクロムd軌道からCOの反結合性軌道へと電子密度が引き抜かれるため、非常に求電子性が高くなり、非局在化した分子軌道を介してベンゼン分子の表面に共有結合することができる。CO 配位子はクロム原子を介してベンゼンから電子密度を誘起効果的に引き抜き、劇的に活性化されたベンゼンは求核攻撃を起こす。ここで求核体は反応してヘキサシクロジエンを作り出すことができる。これはディールス・アルダー反応のシクロ付加などさらなる変化に利用することができる。[25] center|thumb|500x500px|クロムの未占有のd軌道は、ベンゼンから電子を引き抜き、その求電子性を大幅に増大させる。 さらに量子化学は実験データを収集することなく、有機変換の反応機構に見識を与えることがある。波動関数はある分子状態の総エネルギーを備えるため、推測されている分子の幾何学構造は、実験的手法で判明したものと非常に近い、安定状態の分子構造を与えるよう最適化されることがある。[26][page needed] このとき反応座標をシミュレーションし、遷移状態の構造を解明することができる。したがって、特定の反応に対する完全なエネルギー面を解明することが可能であり、このような計算は反応速度論のデータがない場合や取得が難しい有機化学の多くの問題に適用されている。 [1][page needed]
分光法、スペクトロメトリー、結晶学[edit]
物理有機化学分野では、反応過程で分子構造、分子の動態、および反応物の濃度を同定することが多い。これらの特性は分子と光の相互を用いて非破壊的な分光実験をすることで得た豊富なデータから分かる。分子に安定状態の低いエネルギー準位と励起した高いエネルギー準位の2つの状態があり、そのエネルギー差に照射光のエネルギーが一致していると光が吸収される。そして励起状態の分子が低いエネルギー状態に落ちるときに放たれる光を検出する。分光法は、振動(赤外)、回転、電子(紫外可視近赤外)、核磁気共鳴(NMR)、および電子スピン共鳴分光法など、検出される光の励起の状態により広く分類される。こうした分光データに加え、X線回折や質量分析実験で収集した補完的なデータを利用して分子構造の決定が行われる。[27][page needed]
NMR と EPR 分光法[edit]
thumb|外部磁場における核スピンの状態の分裂 核磁気共鳴(NMR)分光法は物理有機化学の主な技術の1つである。実験対象の原子核に外部磁場を当てると常磁性の核はエネルギー状態が正のスピン値と負のスピン値に分岐するため、その状態のエネルギー差を利用する。照射した外部磁場で、励起させてスピン状態を変化させるために必要な光の周波数を測定することにより、エネルギーの差を調べることができる。同じ分子内で区別できない原子核であっても、それらが異なる周波数で吸収すれば、NMRスペクトル中の積分ピーク面積はその周波数に反応する核の数に比例する。[28] スペクトル内のピークを積分することで、異なる有機分子の相対的な濃度を定量化することができるため、多くの反応速度論の実験はただ一度のNMRサンプル内の反応の進行を追跡することによって簡単かつ迅速に行うことができる。プロトンNMRは、特定の官能基についているプロトンが固有の吸収エネルギーをもつため、合成有機化学分野で利用することが多い。しかしNMR分光法は窒素、炭素、フッ素、リン、ホウ素などの同位体にも適用できる。単純な吸収実験の他に、原子交換反応の速度を測定することができ、多次元核オーバーハウザー効果の実験や、二次元NMRスピン-スピンカップリング結合によって原子間距離を決定しを調べることも可能である。[29] 核スピンの励起の特性に加え、同じ基本原理の技術により有機ラジカルの性質も研究できる。非対称電子もネットスピンを持っており、外部磁場をあてて電子スピン共鳴(EPR)分光法により同様の情報を抽出することができる。[1][page needed]
振動(赤外)分光法[edit]
電子励起分光法[edit]
質量分光法[edit]
結晶学[edit]
外部リンク[edit]
- Journal of Physical Organic Chemistry(英語)
- Gaussian, an example of a commercially available quantum mechanical software package used. particularly, in academic settings(英語)
引用元[edit]
- ^ a b c d e f g h i j k Dougherty, Dennis A.; Anslyn, Eric V. (2006). Modern Physical Organic Chemistry. Sausalito, CA, USA: University Science Books. ISBN 9781891389313.[page needed]
- ^ Taft, R W; Deno, N C; Skell, P S (October 1958). "Physical Organic Chemistry". Annual Review of Physical Chemistry. 9 (1): 287–314. Bibcode:1958ARPC....9..287T. doi:10.1146/annurev.pc.09.100158.001443. ISSN 0066-426X.
- ^ Cohen, N.; Benson, S. W. (1 November 1993). "Estimation of heats of formation of organic compounds by additivity methods". Chemical Reviews. 93 (7): 2419–2438. doi:10.1021/cr00023a005.
- ^ Benson, Sidney W.; Cruickshank, F. R.; Golden, D. M.; Haugen, Gilbert R.; O'Neal, H. E.; Rodgers, A. S.; Shaw, Robert; Walsh, R. (1 June 1969). "Additivity rules for the estimation of thermochemical properties". Chemical Reviews. 69 (3): 279–324. doi:10.1021/cr60259a002.
- ^ Carey, Francis A. (2008). Organic Chemistry (7th ed.). Boston, MA, USA: McGraw-Hill. ISBN 9780073047874.[page needed]
- ^ Isaacs, Neil S. (1995). Physical Organic Chemistry (2nd ed.). Harlow, ESS, ENG: Longman Scientific & Technical. ISBN 978-0582218635.[page needed]
- ^ Mo, Yirong; Gao, Jiali (1 February 2007). "Theoretical Analysis of the Rotational Barrier of Ethane". Accounts of Chemical Research. 40 (2): 113–119. doi:10.1021/ar068073w. PMID 17309192.
- ^ Liu, Shubin (7 February 2013). "Origin and Nature of Bond Rotation Barriers: A Unified View". The Journal of Physical Chemistry A. 117 (5): 962–965. Bibcode:2013JPCA..117..962L. doi:10.1021/jp312521z. PMID 23327680.
- ^ Liu, Shubin; Govind, Niranjan (1 July 2008). "Toward Understanding the Nature of Internal Rotation Barriers with a New Energy Partition Scheme: Ethane and-Butane". The Journal of Physical Chemistry A. 112 (29): 6690–6699. Bibcode:2008JPCA..112.6690L. doi:10.1021/jp800376a. PMID 18563887.
- ^ Yamamoto, Takuhei; Chen, Pi-Yu; Lin, Guangxin; Błoch-Mechkour, Anna; Jacobsen, Neil E.; Bally, Thomas; Glass, Richard S. (1 October 2012). "Synthesis and rotation barriers in 2, 6-Di-(-anisyl) anisole" (PDF). Journal of Physical Organic Chemistry. 25 (10): 878–882. doi:10.1002/poc.2939.
- ^ Chen, Chen; Ke, Jiyuan; Zhou, X. Edward; Yi, Wei; Brunzelle, Joseph S.; Li, Jun; Yong, Eu-Leong; Xu, H. Eric; Melcher, Karsten (14 July 2013). "Structural basis for molecular recognition of folic acid by folate receptors". Nature. 500 (7463): 486–489. Bibcode:2013Natur.500..486C. doi:10.1038/nature12327. PMC 5797940. PMID 23851396.
- ^ a b c d McQuarrie, Donald A.; Simon, John D. (1997). Physical Chemistry: A Molecular Approach (Rev. ed.). Sausalito, CA, USA: University Science Books. ISBN 9780935702996. Retrieved 21 June 2015. Note, Amazon rather than Google allows access into this text.[page needed]
- ^ Dougherty, Dennis A.; Anslyn, Eric V. (2006). Modern Physical Organic Chemistry. Sausalito, CA, USA: University Science Books. ISBN 9781891389313.
- ^ Isaacs, Neil S. (1995). Physical Organic Chemistry (2nd ed.). Harlow, ESS, ENG: Longman Scientific & Technical. ISBN 978-0582218635.[page needed]
- ^ a b Dougherty, Dennis A.; Anslyn, Eric V. (2006). Modern Physical Organic Chemistry. Sausalito, CA, USA: University Science Books. ISBN 9781891389313.
- ^ Kevill, Dennis N.; D'Souza, Malcolm J. (1 June 1992). "Concerning the development of scales of solvent ionizing power based on solvolyses of benzylic substrates". Journal of Physical Organic Chemistry. 5 (6): 287–294. doi:10.1002/poc.610050602.
- ^ Dougherty, Dennis A.; Anslyn, Eric V. (2006). Modern Physical Organic Chemistry. Sausalito, CA, USA: University Science Books. ISBN 9781891389313.
- ^ Dougherty, Dennis A.; Anslyn, Eric V. (2006). Modern Physical Organic Chemistry. Sausalito, CA, USA: University Science Books. ISBN 9781891389313.
- ^ Reichardt, Christian; Welton, Thomas (2011). Solvents and solvent effects in organic chemistry (4th, updated and enl. ed.). Weinheim, Germany: Wiley-VCH. ISBN 978-3-527-32473-6.
- ^ Mills, Sander G.; Beak, Peter (1 April 1985). "Solvent effects on keto-enol equilibria: tests of quantitative models". The Journal of Organic Chemistry. 50 (8): 1216–1224. doi:10.1021/jo00208a014.
- ^ Emsley, John; Freeman, Neville J. (1 October 1987). "β-diketone interactions". Journal of Molecular Structure. 161 (1–2): 193–204. Bibcode:1987JMoSt.161..193E. doi:10.1016/0022-2860(87)85074-3.
- ^ Schlund, Sebastian; Basílio Janke, Eline M.; Weisz, Klaus; Engels, Bernd (1 January 2009). "Predicting the tautomeric equilibrium of acetylacetone in solution. I. The right answer for the wrong reason?". Journal of Computational Chemistry. 31 (4): 665–70. doi:10.1002/jcc.21354. PMID 19557765.
- ^ Cite error: The named reference
GaoJACS13was invoked but never defined (see the help page). - ^ Gao, Ming; Patwardhan, Neeraj N.; Carlier, Paul R. (2013). "Stereochemical Inversion of a Cyano-Stabilized Grignard Reagent: Remarkable Effects of the Ethereal Solvent Structure and Concentration". J. Am. Chem. Soc. 135 (38): 14390–14400. doi:10.1021/ja407348s. PMID 23978216.
- ^ Semmelhack, M. F.; Hall, H. T.; Yoshifuji, M. (September 1976). ".eta.5-Cyclohexadienyltricarbonylchromium(0) intermediates in the reaction of carbanions with .eta.6-arenetricarbonylchromium(0)". Journal of the American Chemical Society. 98 (20): 6387–6389. doi:10.1021/ja00436a056.
- ^ Schaefer III, Henry F. (2004). Quantum Chemistry: The Development of ab initio Methods in Molecular Electronic Structure Theory. Chicago, IL, USA: R.R. Donnelly (Courier, Dover). ISBN 978-0486432465. Retrieved 21 June 2015.[page needed]
- ^ Drago, Russell S. (1992). Physical Methods for Chemists (2nd ed.). Ft. Worth, TX, USA: Saunders. ISBN 9780030970375. Retrieved 22 June 2014.[page needed]
- ^ James Keeler. "NMR and energy levels (Ch.2)" (PDF). Understanding NMR Spectroscopy. University of California, Irvine. Retrieved 2013-10-26.
- ^ Keeler, James (2010). Understanding NMR spectroscopy (2nd ed.). Chichester: Wiley. ISBN 978-0-470-74608-0.
[[Category:有機化学]] [[Category:物理化学]] [[Category:分析化学]]

